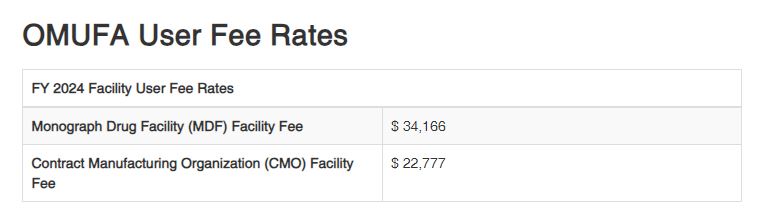
EC No 1223/2009 of Commission Regulation (EU) 2024/996 – 화장품 Retinol, Retinyl Acetate, Retinyl Palmitate 함유 관련
The new Commission Regulation (EU) 2024/996 of 3 April 2024 amending Regulation (EC) No 1223/2009 of the European Parliament and of the Council as regards the use of Vitamin A, Alpha-Arbutin and Arbutin and certain substances with potential endocrine disrupting properties in cosmetic products. Here are the new restrictions: The use of Retinol, Retinyl Acetate and Retinyl Palmitate should be …