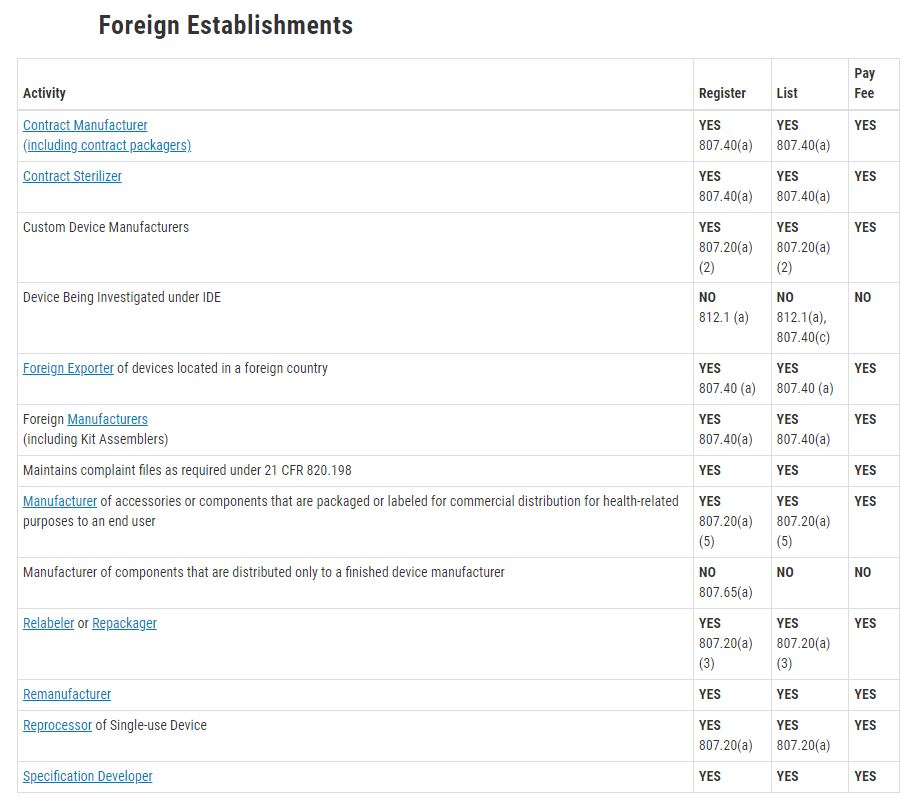
<의료기기 기업 등록 대상>
Contract Manufacturer, Foreign Exporter, Foreign Manufacturer, Relabeler or Repackeger, Specification developer 모두 FDA 의료기기 등록 대상 기업에 해당합니다.
Initial importer는 FDA 의료기기 등록 대상 기업에 해당합니다.
Initial Importer 정의 Any importer who furthers the marketing of a device from a foreign manufacturer to the person who makes final delivery or sale of the device to the ultimate consumer or user, but does not repackage, or otherwise change the container, wrapper, or labeling of the device or device package. The initial importer must have a physical address in the United States staffed by individuals responsible for ensuring the compliance of imported devices with all applicable FDA laws and regulations.
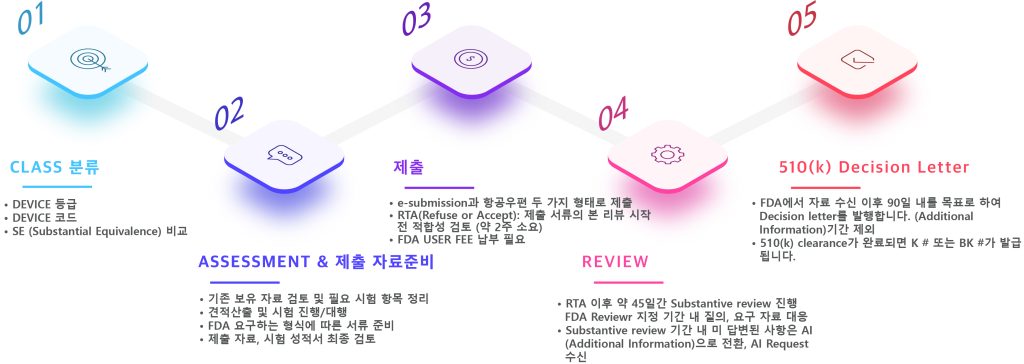
510 (k) Premarket Notification Process
CLASS I Medical Device Listing

